Противовоспалительный и толерогенный потенциал малых пептидов селезенки.
Поддержание периферической иммунной толерантности и предотвращение вредных аутоиммунных реакций является фундаментальной задачей иммунной системы. Однако эти основные функции значительно нарушаются при аутоиммунных расстройствах, что создает серьезную проблему при лечении этих состояний. В этом контексте мы представляем обзор исследований малых селезеночных полипептидов (SSP), которые естественным образом регулируют периферическую иммунную толерантность. Наряду с описанием наблюдаемых эффектов SSP, мы суммируем здесь выводы о клеточных и молекулярных механизмах, лежащих в основе их регуляторного воздействия. В частности, SSP продемонстрировали замечательную эффективность в остановке прогрессирования развивающихся или установленных аутоиммунных расстройств, таких как псориаз или артрит, в животных моделях. Они в первую очередь нацелены на дендритные клетки (DC), быстро вызывая выработку внеклеточного АТФ, который затем разрушается и воспринимается аденозиновыми рецепторами. Этот процесс запускает каскад сигнализации mTOR, аналогичный мощным иммунным триггерам, но вместо быстрой и интенсивной реакции он приводит к умеренной, но значительной активации каскада сигнализации mTOR. Это вызывает толерогенное состояние в дендритных клетках, что в конечном итоге приводит к образованию Foxp3 + иммуносупрессорных Treg-клеток. Кроме того, SSP могут косвенно ослаблять аутоиммунный ответ, снижая внеклеточный синтез АТФ в неиммунных клетках, таких как эндотелиальные клетки, при воздействии повышенных уровней провоспалительных цитокинов. Таким образом, SSP могут способствовать восстановлению периферической иммунной толерантности и могут предложить ценные терапевтические преимущества при лечении аутоиммунных заболеваний.
Введение
Причины и формы аутоиммунных заболеваний многочисленны и разнообразны. Очень часто они начинаются с физического или психического стресса (тяжелое оскорбление, насилие, потеря близких), отравления (например, тяжелыми металлами или агрессивными органическими веществами), паразитарных инвазий, вирусных, бактериальных или грибковых инфекций. Такие факторы оказывают значительную нагрузку на иммунную систему и могут привести к устойчивой активации аутоиммунитета. В нормальных условиях иммунная система может справляться с умеренным стрессом с помощью внутренних регуляторных механизмов, восстанавливающих иммунный баланс, известный как гомеостаз. Однако, если организм регулярно или непрерывно подвергается воздействию провокаторов, поддерживающих воспалительный стресс, давление на иммунную систему становится слишком большим, что приводит к нарушению иммунной толерантности и аутоиммунным расстройствам.
Логическим выводом из этого является стимуляция иммунной системы препаратами, восстанавливающими нарушенный гомеостаз. Однако в настоящее время для этой цели используются только препараты, которые воздействуют на симптомы, а не на причину, такие как нестероидные противовоспалительные препараты, иммунодепрессанты (циклоспорин, метотрексат, азатиоприн) и глюкокортикостероиды (ГКС) ( 1 , 2 ). К сожалению, их длительное применение часто приводит к более серьезным побочным эффектам, чем бремя, вызванное основным заболеванием, включая оппортунистические инфекции, миопатию, желудочно-кишечные проблемы и недостаточность органов ( 3 , 4 ). В последнее время стали использовать моноклональные антитела, нацеленные на воспалительные цитокины и их рецепторы, которые воздействуют на отдельные воспалительные факторы, но не устраняют причину воспаления и, таким образом, также оказывают только симптоматическое действие ( 5–7 ) .
Учитывая врожденную способность иммунной системы восстанавливать равновесие, очевидно, что при тяжелых аутоиммунных заболеваниях эта способность должна быть реактивирована посредством внешнего фармакологического стимула. Этот стимул должен имитировать естественный процесс и должен обладать способностью вызывать периферический толерогенез, тем самым помогая в восстановлении баланса иммунной системы. Такой подход представлял бы собой идеальное решение, особенно при тяжелом аутовоспалении или аутоиммунных заболеваниях.
Селезенка является как вторичным лимфоидным органом, так и крупнейшим иммунным органом в организме, играя жизненно важную роль в иммунной функции и общем здоровье ( 8 , 9 ). Она действует как важный фильтр для патогенов и антигенов в крови, вносит значительный вклад в метаболизм железа и гомеостаз эритроцитов, а также служит резервуаром для иммунных клеток ( 10–12 ). Кроме того, селезенка играет решающую роль как во врожденных, так и в адаптивных иммунных реакциях, поддерживая периферический иммунный гомеостаз и дополняя центральную иммунную толерантность ( 9 , 10 , 12 ). В соответствии с этим, некоторые публикации подчеркивают положительные иммуностимулирующие и детоксикационные эффекты экстракорпоральной перфузии донорской или свиной ксеноселезенки у пациентов с определенными заболеваниями , такими как системная красная волчанка или септические осложнения ( 13–15 ). Сообщалось также, что трансплантация селезенки имеет толерогенный эффект в некоторых моделях грызунов ( 16 ) .
Хотя селезенка, несомненно, играет центральную роль в развитии аутоиммунных заболеваний, эффекты удаления селезенки на прогрессирование этих заболеваний часто сложны. Исследования на животных моделях показали, что у мышей или крыс, перенесших спленэктомию, развивались аутоиммунные заболевания, подобные таковым в контрольной группе, но с изменениями в клеточных и гуморальных иммунных реакциях, которые были более разнонаправленными, вероятно, из-за компенсаторного эффекта лимфатических узлов ( 17–19 ) . Клинические исследования также связывают спленэктомию с развитием новых аутоиммунных явлений и с изменениями в клиническом течении у пациентов с уже существующими аутоиммунными заболеваниями. Например, в одном отчете о случае было зафиксировано возникновение гломерулонефрита и антифосфолипидного синдрома после плановой спленэктомии у пациента, которому ранее был поставлен диагноз аутоиммунного гепатита и ревматоидного артрита ( 20 ). Сложные эффекты спленэктомии могут зависеть от конкретного аутоиммунного заболевания, индивидуальных характеристик пациента и потенциальных компенсаторных механизмов, включающих другие периферические лимфоидные органы.
Недавно некоторые опубликованные исследования показали, что селезенка естественным образом содержит небольшие полипептиды с иммуномодулирующими свойствами ( 21–23 ). Эти полипептиды способны стимулировать пролиферацию нескольких иммунных клеток, вызывать выработку важных цитокинов, таких как IL-2, IL-4, IFNγ и TNFα, и повышать уровень иммуноглобулинов ( 21 ) . При введении мышам эти полипептиды смогли повысить их выживаемость после заражения вирусом гриппа А за счет усиления опосредованных Т-лимфоцитами защитных механизмов против вируса гриппа А ( 23 ). Кроме того, было показано, что эти небольшие полипептиды противодействуют аутоиммунной активации и обладают потенциалом регулировать аутоиммунные заболевания ( 22 , 24 ). Скрытый потенциал селезенки в этом отношении с нетерпением ждет активации. Целью данного обзора является консолидация наших знаний о влиянии SSP на подавление возникновения аутоиммунных заболеваний in vivo , а также изучение лежащих в их основе клеточных и молекулярных механизмов. Феноменология: противовоспалительное действие SSP in vivo
В поисках природных регуляторов периферической иммунной толерантности весь пул белков селезенки был тщательно фракционирован в соответствии с их молекулярной массой. Удивительно, но только фракция с молекулярной массой менее 12 кДа показала значительный противовоспалительный эффект. Напротив, фракция белков с более высокой молекулярной массой, которая, как ожидается, содержит большую часть регуляторных иммунных цитокинов, обнаруженных в селезенке, не продемонстрировала никакого эффекта ( 22 ).
Введение малой фракции селезеночного полипептида трансгенным мышам ihTNFtg, у которых наблюдался тяжелый псориатический артрит, вызванный повышенным уровнем цитокина hTNFα после стимуляции доксициклином ( 25 ), привело к значительному ингибированию как псориаза, так и артрита ( 22 ). Примечательно, что SSP не только препятствовали возникновению и прогрессированию псориатического артрита, но и останавливали прогрессирование уже существующего гипервоспалительного заболевания. Особенно примечательным был тот факт, что эти результаты наблюдались, несмотря на сохраняющиеся высокие уровни растворимого hTNFα в кровотоке и пораженных тканях, что подчеркивает мощные противовоспалительные свойства SSP. Примечательно, что источник полипептидов, будь то селезенка свиней, крупного рогатого скота или мышей, не имел значения для их функции ( 22 , 24 ).
Снижение тяжести аутоиммунного заболевания, опосредованное SSP, было связано с уменьшением экспрессии воспалительных маркеров, таких как S100A9 и Ki-67, а также со снижением инфильтрации иммунных клеток в пораженных тканях кожи и суставов ( 22 ). Кроме того, наблюдалось увеличение количества CD25 + /CTLA4 + /Foxp3 + ингибирующих CD4 Treg-клеток в региональных лимфатических узлах. Стоит отметить, что истощение CD25-положительного пула CD4 Treg-клеток у мышей отменило противовоспалительное действие SSP. Примечательно, что все эти эффекты наблюдались, несмотря на присутствие чрезвычайно высоких уровней цитокина hTNFα ( 22 ). Эти результаты подчеркивают комплексное воздействие SSP на облегчение аутоиммунных заболеваний, охватывающее модуляцию воспалительных маркеров, инфильтрацию иммунных клеток и баланс регуляторных Т-клеток. SSP нацелены на дендритные клетки
Противовоспалительный эффект SSP в сочетании с увеличением количества Treg-клеток предполагает, что иммунные клетки являются основными мишенями SSP. Однако, когда макрофаги или Т-лимфоциты были напрямую стимулированы SSP in vitro , никакого эффекта на их активацию не наблюдалось. Кроме того, у мышей ihTNFtg/Rag1 KO , у которых отсутствуют зрелые Т- и В-лимфоциты, но имеется неповрежденная врожденная иммунная система, SSP не проявляли противовоспалительного эффекта ( 22 ). У этих мышей развивается более тяжелое заболевание, чем у мышей ihTNFtg, из-за повышенной инфильтрации воспаленных участков макрофагами ( 26 ). Однако лечение SSP не изменило воспаление кожи или лап или экспрессию hTNFα у мышей ihTNFtg/Rag1 KO . Это предполагает, что SSP в первую очередь влияют на адаптивную, а не на врожденную иммунную систему и что Т-клетки не подвергаются прямому воздействию.
Поскольку активация Т-клеток, включая иммуносупрессивные клетки Foxp3 + Treg, зависит от участия дендритных клеток (ДК) и их антигенпрезентирующего рецептора MHCII, а также костимулирующих молекул, таких как CD80/86 (кластер дифференциации 80/86), CD40, PD-L1/2 или CD205, эти клетки были подвергнуты детальному исследованию. Примечательно, что было обнаружено, что SSP индуцируют экспрессию толерогенных рецепторов, таких как PD-L1 и CD205, в незрелых ДК, направляя их к толерогенной дифференциации ( 22 ). Примечательно, что этот эффект был более выражен в случаях, когда и ДК, и Т-клетки CD4 были из сингенных источников с минимальными антигенными различиями, в отличие от аллогенных источников с более высокой антигенностью. Это говорит о том, что SSP демонстрируют эффективность в тонкой настройке иммунных ответов, особенно в сценариях, включающих низкопороговые антигенные различия, обычно наблюдаемые при хронических аутоиммунных заболеваниях. Кроме того, SSP были столь же эффективны, как классические индукторы толерогенности, такие как IL-10 или TGFβ, в своей способности вызывать толерогенез незрелых ДК, но механизм активации ДК с помощью SSP отличался от механизма IL-10 или TGFβ и не имитировал апоптоз-опосредованную толерогенную стимуляцию ( 22 , 24 , 27 ). SSP в первую очередь нацелены на ДК и вызывают толерогенное состояние, которое приводит к индукции Foxp3 + иммуносупрессорных Treg-клеток, а последнее требует прямого контакта между активированными SSP ДК и наивными CD4 + Т-клетками через иммунные контрольные точки PD-1 и CTLA4-рецепторы Т-клеток ( 22 ). Таким образом, SSP представляют собой естественные селезеночные полипептиды, способные восстанавливать нарушенную периферическую толерантность и предотвращать аутоиммунные заболевания без очевидных побочных эффектов, обычно связанных с использованием IL-10 или TGFβ ( 28 , 29 ), что делает SSP чрезвычайно привлекательными в качестве противовоспалительных препаратов. Тимозины являются основными компонентами SSP.
Очевидно, что критическим вопросом, связанным с описанными явлениями, была идентификация активных веществ в образцах SSP. Соответственно, был проведен тандемный масс-спектрометрический анализ образцов SSP, выявивший тимозины как основные компоненты препаратов SSP. Были идентифицированы тимозин бета 4, тимозин бета 10, паратимозин и протимозин альфа, причем тимозин бета 4 (Tβ4) оказался наиболее распространенным полипептидом, превосходящим другие формы тимозина на 1-2 порядка по содержанию ( 24 ). Это открытие было как неожиданным, так и захватывающим, учитывая, что эти небольшие полипептиды широко распространены во всех тканях животных и известны своими разнообразными биологическими эффектами. Tβ4 высококонсервативен в широком спектре организмов, от беспозвоночных до млекопитающих, и первоначально был идентифицирован как белок, который связывается с G-актином, предотвращая его полимеризацию ( 30 ). Tβ4 не только локализуется внутри клеток, но также может высвобождаться во внеклеточное пространство с помощью пока неизвестных механизмов. У млекопитающих самые высокие уровни были продемонстрированы в селезенке ( 31 ). Помимо регулирования динамики цитоскелета, Tβ4 участвует в миграции клеток, ремоделировании тканей, ангиогенезе и привлечении стволовых клеток в поврежденные ткани ( 30 , 32 ). Кроме того, он демонстрирует противовоспалительные свойства и защищает клетки от окислительного стресса. Исследования также предполагают возможную роль Tβ4 в патогенезе ревматоидного артрита (РА), поскольку значительное повышение уровня Tβ4 наблюдалось в синовиальной жидкости и сыворотке пациентов с РА, что, по-видимому, предотвращает активацию иммунных реакций, связанных с РА ( 33 ). Несмотря на свою короткую длину, состоящую всего из 43 аминокислот (5 кДа), полипептид подвергается различным посттрансляционным модификациям, включая гликозилирование, ацетилирование или фосфорилирование во многих местах. Кроме того, N-концевой пептид из четырех аминокислот, известный как Ac-SDKP, может быть освобожден из Tβ4 посредством ферментативного гидролиза, что приводит к удалению первого метионина и N-ацетилированию пептида. Следовательно, вторичные модификации Tβ4 и его производного Ac-SDKP были признаны критически важными для биологической активности молекулы Tβ4 ( 32 , 34 ).
Удивительно, но, несмотря на хорошо документированную роль Tβ4 в различных физиологических процессах, таких как заживление ран, регенерация тканей и иммуномодуляция, его очищенные рекомбинантные образцы продемонстрировали сниженную эффективность в качестве противовоспалительных препаратов in vivo по сравнению с образцами SSP ( 24 ). Вполне вероятно, что полученные естественным путем SSP содержат уникальные варианты тимозина, которые синергически усиливают эффекты друг друга, или что посттрансляционные модификации, имеющие решающее значение для биологической активности, недостаточно присутствуют в рекомбинантных или химически синтезированных образцах. Также возможно, что сочетание обоих факторов способствует этому несоответствию. Следовательно, эти результаты не только подтверждают, но и подчеркивают жизненно важную роль SSP как естественных регуляторов периферической иммунологической толерантности in vivo . Молекулярный механизм действия SSP
Структура белка тимозинов очень похожа на структуру ингибирующего фактора 1 (IF1) экто-АТФ-синтазы, который является связывающим фактором этого мембранного фермента ( 35 ). IF1 функционирует для ингибирования чрезмерного гидролиза АТФ путем связывания с компонентом F1 экто-АТФ-синтазы, тем самым препятствуя его обратному движению и гидролизу АТФ. Однако более поздние открытия указывают на то, что IF1 также может влиять на активность синтеза АТФ ( 36 , 37 ). Кроме того, было показано, что Tβ4 прочно связывается с α- и β-субъединицами мембранной АТФ-синтазы и, подобно IF1, влияет на функцию экто-АТФ-синтазы ( 35 ). Стоит отметить, что как тимозины, так и внеклеточный АТФ (exATP) известны своим влиянием на активность иммунного ответа ( 32 , 38 ).
И действительно, SSP оказались важнейшими регуляторами клеточных уровней exATP ( 24 ). Мониторинг содержания АТФ в реальном времени в незрелых ДК показал, что SSP вызывают значительный de novo синтез exATP. Этот синтез достигал пика примерно через два часа после начала стимуляции, за которым следовала быстрая деградация. Интересно, что поведение SSP напоминало поведение других толерогенных стимулов, таких как IL-10 или TGFβ, но значительно отличалось от поведения иммуногенных стимулов, таких как LPS или GM-CSF+IL-4. Последние факторы вызывали лишь умеренный de novo синтез exATP, хотя и с отсроченной деградацией.
Значительные различия в синтезе и деградации exATP имеют заслуживающие внимания биологические последствия. Особое значение в этом контексте имеет продукт деградации АТФ аденозин, признанный важнейшим толерогенным стимулом, в отличие от АТФ, который обычно рассматривается как «сигнал опасности», способствующий иммунным реакциям ( 38–41 ) . Эксперименты показывают, что разница в уровнях аденозина на поверхности ДК, возникающая в результате толерогенных SSP или иммуногенных факторов, относительно невелика, всего в 2–3 раза ( 24 ). Однако эта тонкая вариация в конечном итоге сыграла решающую роль в определении судьбы ДК, будут ли они далее специализироваться в направлении толерогенеза или иммуногенеза.
Этот вывод был дополнительно подкреплен ингибированием аденозиновых рецепторов на ДК во время их стимуляции SSP или другими толерогенными стимулами. Блокирование аденозиновых рецепторов привело к заметному снижению их способности стимулировать толерогенные клетки Foxp3 + Treg. Однако эта блокада не повлияла на пролиферацию клеток CD4 + или их дифференциацию в иммуногенные клетки Tbet + Th1 ( 24 ).
Подобно другим клеткам, дифференциация незрелых ДК в специализированные иммуногенные или толерогенные клетки регулируется специфическими стимулами, которые активируют внутриклеточные сигнальные пути. В этом контексте сигнальный путь mTOR (млекопитающая мишень рапамицина), по-видимому, играет центральную роль в опосредованном SSP толерогенном развитии ДК ( 27 ). Углубленный анализ активации пути mTOR SSP показал, что, вопреки преобладающему в литературе представлению о том, что этот путь активируется только в ДК во время иммуногенеза и подавляется во время толерогенеза, каскад mTOR активно активируется во время толерогенной стимуляции, только режим активации отличается от режима иммуногенной стимуляции ( 27 ). Различие в активации mTOR между иммуногенными и толерогенными стимулами является количественным, а не качественным. В то время как иммуногенная активация быстрая, сильная и устойчивая, активность, вызванная толерогенными SSP, отсроченная, менее интенсивная, но все еще значительная. В обоих случаях активация mTOR в первую очередь происходит через сигнальную ось PI3K/Akt и включает киназы ERK и GSK3β с минимальным участием путей AMPK или NF-kB ( 27 ). В то время как кинетика активации каскада mTOR после стимуляции SSP не отличалась от кинетики других толерогенных стимулов, инициация этой активации, по-видимому, отличается. В случае SSP активация mTOR, по-видимому, включает аденозиновые рецепторы, в отличие от случая иммуногенеза, стимулированного ЛПС. Как индукция каскада mTOR в ДК ( 27 ), так и результирующая экспрессия толерогенных маркеров ( 22 ) отличались от тех, которые были вызваны IL-10 или TGFβ, что подчеркивает уникальную природу SSP.
Интересно, что среди аденозиновых рецепторов только A1 и A3, а не A2A и A2B, по-видимому, играют критическую роль в опосредованном SSP толерантном генезе ДК, поскольку только их взаимодействие приводит к активации каскада сигнализации mTOR ( 27 ). Это открытие согласуется с результатами, указывающими на то, что ингибирование PKA не оказывает существенного влияния на активацию mTOR, вызванную SSP. В этом контексте следует отметить, что, хотя все четыре аденозиновых рецептора относятся к классу пуринергических рецепторов, сопряженных с G-белком, они сигнализируют по-разному. Подтипы A2A и A2B в основном передают сигнал через белки Gs, что приводит к активации аденилатциклазы и стимуляции образования циклического аденозинмонофосфата (цАМФ), а также активации PKA. Напротив, подтипы А1 и А3 передают сигнал через белки Gi, что приводит к ингибированию аденилатциклазы и ПКА ( 42 , 43 ). SSP снижают синтез exATP, вызванный воспалительными цитокинами, в неиммунных клетках
Основной целью этого обзора было консолидировать существующие выводы о SSP как естественных регуляторах периферической иммунологической толерантности, охватывая феноменологию на уровне организма во время аутоиммунных заболеваний и лежащие в их основе клеточные и молекулярные механизмы. Однако, учитывая, что образцы SSP состоят в основном из тимозинов, в частности Tβ4, который известен своим нацеливанием на различные клетки и множеством биологических эффектов, которые он оказывает, было разумно предположить, что SSP могут иметь дополнительные эффекты. Эти дополнительные эффекты могут косвенно влиять на регуляцию иммунных реакций, опосредованных тимозинами, тему, которую мы кратко рассмотрим здесь. Это включает роль Tβ4 в заживлении ран роговицы, где он способствует миграции эпителиальных клеток, уменьшает воспаление и подавляет апоптоз ( 44 ). Кроме того, он способствует выживанию и ангиогенезу трансплантированных эндотелиальных клеток-предшественников в инфарктном миокарде и принимает участие в регуляции роста волос ( 32 , 45–47 ). Особого внимания заслуживает его способность влиять на развитие эндотелиальных клеток микрососудов и муральных клеток, тем самым способствуя стабильности сосудистой стенки ( 48–50 ). Это важно, поскольку эндотелиальные клетки микрососудов играют ключевую роль в микроциркуляторных заболеваниях, таких как тромботические микроангиопатии и диффузное внутрисосудистое свертывание крови, и их активация является важной особенностью при этих состояниях ( 51 ). Кроме того, эндотелиальные клетки играют решающую роль в поддержании текучести крови и обеспечении контролируемого сосудистого гемостаза в местах повреждения, тем самым способствуя многочисленным механизмам, которые должны поддерживаться в равновесии ( 52 ).
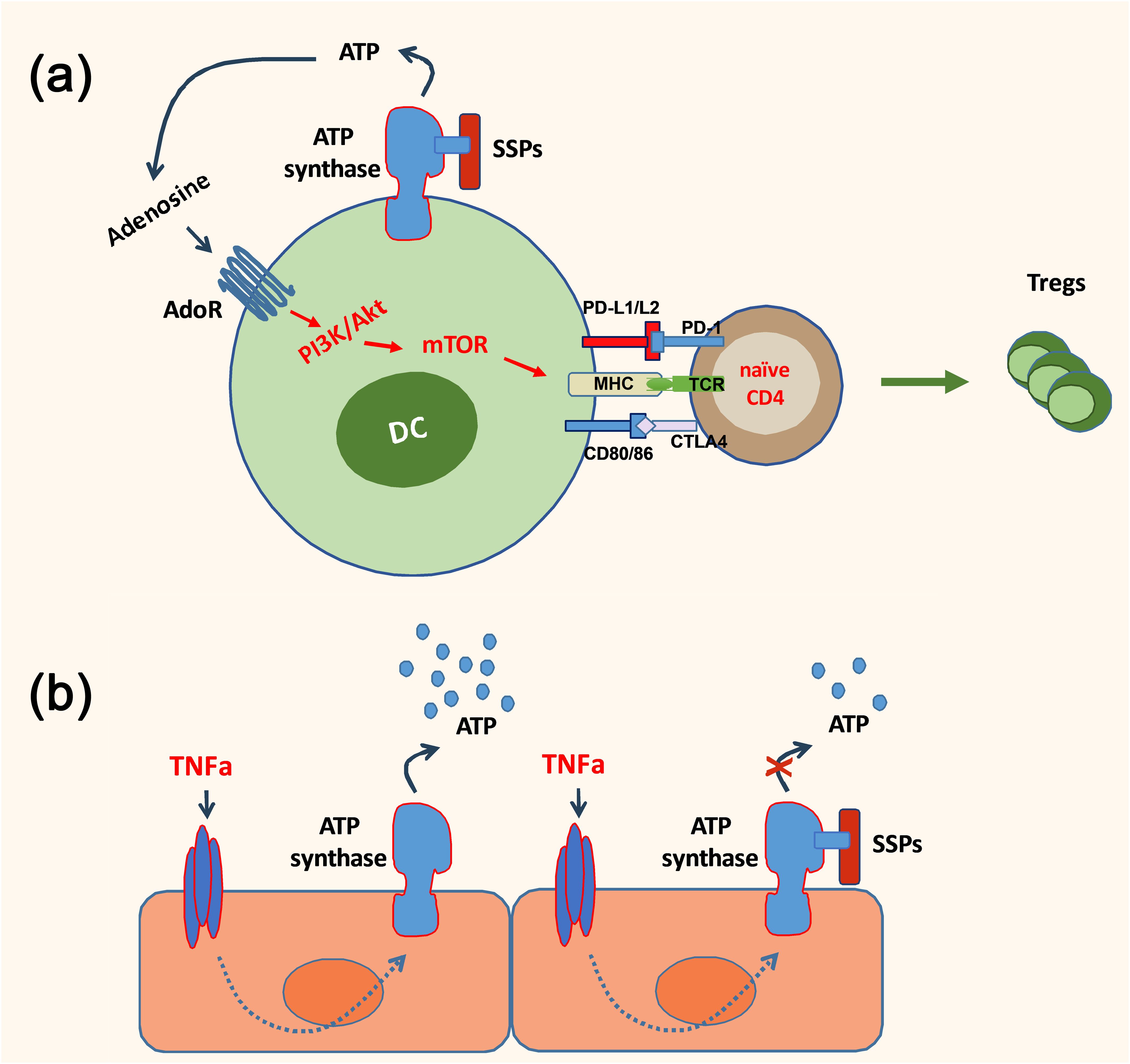
Таким образом, учитывая, что Tβ4 является наиболее распространенным компонентом образцов SSP и регулирует синтез и деградацию exATP в DC, было исследовано, могут ли эти противовоспалительные, толерогенные агенты также уменьшить высвобождение АТФ в неиммунных клетках. В частности, основное внимание уделялось клеткам, выстилающим более мелкие кровеносные сосуды, которые являются основными мишенями для растворимых провоспалительных цитокинов и чужеродных иммунных веществ, таких как ЛПС, тем самым способствуя хроническому воспалению тканей. Эти исследования показали, что регуляция уровней exATP во время воспалительных состояний, по-видимому, является общей характеристикой SSP. SSP продемонстрировали снижение синтеза exATP в различных типах клеток, включая синовиальные фибробласты пациентов с артритом, кератиноциты и муральные клетки, при воздействии провоспалительных факторов ( 24 ). Этот эффект был особенно выражен в первичных эндотелиальных клетках и перицитах, что подчеркивает противовоспалительные свойства SSP. Таким образом, по-видимому, SSP играют роль в снижении аутоиммунных реакций посредством прямой модуляции ДК посредством стимуляции их синтеза и деградации внАТФ, а также косвенно, посредством ослабления синтеза АТФ в неиммунных клетках, вызванного провоспалительными цитокинами ( рисунок 1 ). Рисунок 1 www.frontiersin.org
Рисунок 1. Упрощенная схема, иллюстрирующая противовоспалительное действие SSP. SSP могут оказывать прямое влияние на иммунный ответ, вызывая превращение дендритных клеток в толерогенные клетки, тем самым способствуя образованию клеток Foxp3 + Treg (A) . Кроме того, они могут косвенно модулировать иммунный ответ, снижая синтез exATP в неиммунных клетках, таких как эндотелиальные клетки, который индуцируется провоспалительными цитокинами (B) . Выводы и перспективы на будущее
В совокупности, обобщенные здесь исследования однозначно демонстрируют толерогенные свойства SSP ( 22 , 24 , 27 ). Они показали высокую эффективность in vivo и оказались столь же эффективными в создании иммуносупрессивных Treg-клеток, как и канонические толерогенные факторы, такие как IL-10 и TGFβ. SSP, по-видимому, достигают своей противовоспалительной и толерогенной функции, регулируя синтез exATP и его превращение в аденозин. В то время как время индукции и деградации exATP, а также кинетика активации каскада сигнализации mTOR отражали таковые канонических стимулов IL-10 и TGFβ, механизмы стимуляции DC были различны. Они были способны оказывать свои противовоспалительные эффекты даже в присутствии высоких концентраций провоспалительных цитокинов. Кроме того, ожидается, что их использование в качестве естественных регуляторов развития толерантности приведет к снижению воспалительных побочных эффектов, поскольку они не вызывают фосфорилирование белков STAT или SMAD, которые типичны для стимулов IL-10 и TGFβ и связаны с воспалением. Это, в сочетании с тем фактом, что SSP активно снижают вредные уровни exATP, вызванные провоспалительными стимулами в неиммунных клетках, таких как эндотелиальные клетки и перициты, и их потенциальной способностью регулировать сосудистый тонус, делает их привлекательными кандидатами для разработки лекарств, особенно учитывая, что SSP показали лучшую противоартритную активность, чем чистый Tβ4. Наконец, учитывая замечательный успех SSP в борьбе с аутоиммунными расстройствами у лабораторных животных, кажется многообещающим исследовать комбинированную эффективность SSP с противовоспалительными методами лечения, направленными на снижение различных аутоиммунных триггеров и, таким образом, усиление противовоспалительного эффекта SSP, и начать клинические испытания как можно скорее.
Ссылки
оригинал статьи
- Affaitati G, Martelletti P, Lopopolo M, Tana C, Massimini F, Cipollone F, et al. Use of nonsteroidal anti-inflammatory drugs for symptomatic treatment of episodic headache. Pain Pract. (2017) 17:392–401. doi: 10.1111/papr.12461
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Cho S-K, Kim H, Park H-R, Choi W, Choi S, Jung S-Y, et al. Nonsteroidal anti-inflammatory drugs-sparing effect of symptomatic slow-acting drugs for osteoarthritis in knee osteoarthritis patients. J Rheum Dis. (2019) 26:179–85. doi: 10.4078/jrd.2019.26.3.179
| Crossref Full Text |
Google Scholar |
- Noetzlin S, Breville G, Seebach JD, Gastaldi G. Short-term glucocorticoid-related side effects and adverse reactions: A narrative review and practical approach. Swiss Med Wkly. (2022) 152:w30088. doi: 10.4414/smw.2022.w30088
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Oray M, Abu Samra K, Ebrahimiadib N, Meese H, Foster CS. Long-term side effects of glucocorticoids. Expert Opin Drug Saf. (2016) 15:457–65. doi: 10.1517/14740338.2016.1140743
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Kunnumakkara AB, Thakur KK, Rana V, Bora B, Banik K, Khatoon E, et al. Upside and downside of tumor necrosis factor blockers for treatment of immune/inflammatory diseases. Crit Rev Immunol. (2019) 39:439–79. doi: 10.1615/CritRevImmunol.2020033205
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Lim SH, Kim K, Choi CI. Pharmacogenomics of monoclonal antibodies for the treatment of rheumatoid arthritis. J Pers Med. (2022) 12. doi: 10.3390/jpm12081265
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Zheng S, Hunter DJ, Xu J, Ding C. Monoclonal antibodies for the treatment of osteoarthritis. Expert Opin Biol Ther. (2016) 16:1529–40. doi: 10.1080/14712598.2016.1229774
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Yu H, Cai Y, Zhong A, Zhang Y, Zhang J, Xu S. The “Dialogue” between central and peripheral immunity after ischemic stroke: focus on spleen. Front Immunol. (2021) 12:792522. doi: 10.3389/fimmu.2021.792522
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Zhao L, Liu L, Guo B, Zhu B. Regulation of adaptive immune responses by guiding cell movements in the spleen. Front Microbiol. (2015) 6:645. doi: 10.3389/fmicb.2015.00645
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Bronte V, Pittet MJ. The spleen in local and systemic regulation of immunity. Immunity. (2013) 39:806–18. doi: 10.1016/j.immuni.2013.10.010
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Lewis SM, Williams A, Eisenbarth SC. Structure and function of the immune system in the spleen. Sci Immunol. (2019) 4. doi: 10.1126/sciimmunol.aau6085
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Aliyu M, Zohora F, Saboor-Yaraghi AA. Spleen in innate and adaptive immunity regulation. AIMS Allergy Immunol. (2021) 5:1–17. doi: 10.3934/Allergy.2021001
| Crossref Full Text |
Google Scholar |
- Shelobod AL, Bekchintaev TN. a modified method of using xenogeneic spleen in suppurative- septic diseases. Vestn Khir Im I I Grek. (1991) 146:96–9.
| PubMed Abstract |
Google Scholar |
- Tsypin AB, Nasonova VA, Vedernikova LA, Solov’ev SK, Velikaia MV, Chiklikchi AS, et al. Splenic perfusion in the combined treatment of patients with systemic lupus erythematosus. Ter Arkh. (1993) 65:61–5.
| PubMed Abstract |
Google Scholar |
- Zhidkov KP, Medvedev Iu A, Dobrynskii EK, Kopylov SM, Belova LA. Extracorporeal perfusion of the xenospleen in the treatment of suppurative surgical diseases. Vestn Khir Im I I Grek. (1986) 137:86–91.
| PubMed Abstract |
Google Scholar |
- Dor FJ, Gollackner B, Cooper DK. Can spleen transplantation induce tolerance? A review of the literature. Transpl Int. (2003) 16:451–60. doi: 10.1007/s00147-003-0640-0
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Khanfar E, Olasz K, Gajdocsi E, Jia X, Berki T, Balogh P, et al. Splenectomy modulates the immune response but does not prevent joint inflammation in a mouse model of ra. Clin Exp Immunol. (2022) 209:201–14. doi: 10.1093/cei/uxac052
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Khanfar E, Olasz K, Gal S, Gajdocsi E, Kajtar B, Kiss T, et al. Splenectomy at early stage of autoimmune arthritis delayed inflammatory response and reduced joint deterioration in mice. Clin Exp Immunol. (2024) 216:240–51. doi: 10.1093/cei/uxae013
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Weetman AP, McGregor AM, Rennie DP, Hassman R, Hall R. The role of the spleen in experimental autoimmune thyroiditis. Clin Exp Immunol. (1984) 56:135–42.
| PubMed Abstract |
Google Scholar |
- Patel S, Kramer N, Rosenstein ED. Evolving connective tissue disease influenced by splenectomy: beneath the sword of dameshek. J Clin Rheumatol. (2010) 16:280–3. doi: 10.1097/RHU.0b013e3181eeb761
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Liu C, Ding WJ, Huo Y, Liu AJ. Comprehensive assessment of peptide derived from pig spleen: preparation, bioactivity and structure-activity relationships. Food Bioscience. (2023) 56. doi: 10.1016/j.fbio.2023.103361
| Crossref Full Text |
Google Scholar |
- Wixler V, Zaytsev IZ, Leite Dantas R, Schied T, Boergeling Y, Luhrmann V, et al. Small spleen peptides prevent development of psoriatic arthritis via restoration of peripheral tolerance. Mol Ther. (2022) 30:745–62. doi: 10.1016/j.ymthe.2021.08.030
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- van’t Veeno A, de Ruyter H, Mouton JW, Hartleb M, Lachmann B. Pretreatment with spleen peptides can enhance survival in influenza a infected mice. Res Complementary Med. (2009) 3:218–21. doi: 10.1159/000210231
| Crossref Full Text |
Google Scholar |
- Wixler V, Leite Dantas R, Varga G, Boergeling Y, Ludwig S. Small spleen peptides (Ssps) shape dendritic cell differentiation through modulation of extracellular atp synthesis profile. Biomolecules. (2024) 14. doi: 10.3390/biom14040469
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Retser E, Schied T, Skryabin BV, Vogl T, Kanczler JM, Hamann N, et al. Doxycycline-induced expression of transgenic human tumor necrosis factor alpha in adult mice results in psoriasis-like arthritis. Arthritis Rheum. (2013) 65:2290–300. doi: 10.1002/art.38026
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Leite Dantas R, Masemann D, Schied T, Bergmeier V, Vogl T, Loser K, et al. Macrophage-mediated psoriasis can be suppressed by regulatory T lymphocytes. J Pathol. (2016) 240:366–77. doi: 10.1002/path.4786
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Wixler V, Boergeling Y, Leite Dantas R, Varga G, Ludwig S. Conversion of dendritic cells into tolerogenic or inflammatory cells depends on the activation threshold and kinetics of the mtor signaling pathway. Cell Commun Signal. (2024) 22:281. doi: 10.1186/s12964-024-01655-1
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Carlini V, Noonan DM, Abdalalem E, Goletti D, Sansone C, Calabrone L, et al. The multifaceted nature of il-10: regulation, role in immunological homeostasis and its relevance to cancer, Covid-19 and post-Covid conditions. Front Immunol. (2023) 14:1161067. doi: 10.3389/fimmu.2023.1161067
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Danielpour D. Advances and challenges in targeting tgf-beta isoforms for therapeutic intervention of cancer: A mechanism-based perspective. Pharm (Basel). (2024) 17. doi: 10.3390/ph17040533
| Crossref Full Text |
Google Scholar |
- Goldstein AL, Hannappel E, Sosne G, Kleinman HK. Thymosin beta4: A multi-functional regenerative peptide. Basic properties and clinical applications. Expert Opin Biol Ther. (2012) 12:37–51. doi: 10.1517/14712598.2012.634793
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Hannappel E. Thymosin beta4 and its posttranslational modifications. Ann N Y Acad Sci. (2010) 1194:27–35. doi: 10.1111/j.1749-6632.2010.05485.x
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Xing Y, Ye Y, Zuo H, Li Y. Progress on the function and application of thymosin beta4. Front Endocrinol (Lausanne). (2021) 12:767785. doi: 10.3389/fendo.2021.767785
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Kim KS, Yang HI. Thymosin beta4 in rheumatoid arthritis: friend or foe. BioMed Rep. (2017) 7:205–8. doi: 10.3892/br.2017.952
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Kumar N, Yin C. The anti-inflammatory peptide ac-sdkp: synthesis, role in ace inhibition, and its therapeutic potential in hypertension and cardiovascular diseases. Pharmacol Res. (2018) 134:268–79. doi: 10.1016/j.phrs.2018.07.006
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Freeman KW, Bowman BR, Zetter BR. Regenerative protein thymosin beta-4 is a novel regulator of purinergic signaling. FASEB J. (2011) 25:907–15. doi: 10.1096/fj.10-169417
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Gatto C, Grandi M, Solaini G, Baracca A, Giorgio V. The F1fo-atpase inhibitor protein if1 in pathophysiology. Front Physiol. (2022) 13:917203. doi: 10.3389/fphys.2022.917203
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Gore E, Duparc T, Genoux A, Perret B, Najib S, Martinez LO. The multifaceted atpase inhibitory factor 1 (If1) in energy metabolism reprogramming and mitochondrial dysfunction: A new player in age-associated disorders? Antioxid Redox Signal. (2022) 37:370–93. doi: 10.1089/ars.2021.0137
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Feng LL, Cai YQ, Zhu MC, Xing LJ, Wang X. The yin and yang functions of extracellular atp and adenosine in tumor immunity. Cancer Cell Int. (2020) 20:110. doi: 10.1186/s12935-020-01195-x
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Pasquini S, Contri C, Borea PA, Vincenzi F, Varani K. Adenosine and inflammation: here, there and everywhere. Int J Mol Sci. (2021) 22. doi: 10.3390/ijms22147685
| Crossref Full Text |
Google Scholar |
- Cauwels A, Rogge E, Vandendriessche B, Shiva S, Brouckaert P. Extracellular atp drives systemic inflammation, tissue damage and mortality. Cell Death Dis. (2014) 5:e1102. doi: 10.1038/cddis.2014.70
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Faas MM, Saez T, de Vos P. Extracellular atp and adenosine: the yin and yang in immune responses? Mol Aspects Med. (2017) 55:9–19. doi: 10.1016/j.mam.2017.01.002
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Silva-Vilches C, Ring S, Mahnke K. Atp and its metabolite adenosine as regulators of dendritic cell activity. Front Immunol. (2018) 9:2581. doi: 10.3389/fimmu.2018.02581
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Bahreyni A, Khazaei M, Rajabian M, Ryzhikov M, Avan A, Hassanian SM. Therapeutic potency of pharmacological adenosine receptor agonist/antagonist in angiogenesis, current status and perspectives. J Pharm Pharmacol. (2018) 70:191–6. doi: 10.1111/jphp.12844
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Dunn SP, Heidemann DG, Chow CY, Crockford D, Turjman N, Angel J, et al. Treatment of chronic nonhealing neurotrophic corneal epithelial defects with thymosin beta 4. Arch Ophthalmol. (2010) 128:636–8. doi: 10.1001/archophthalmol.2010.53
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Dai B, Sha RN, Yuan JL, Liu DJ. Multiple potential roles of thymosin beta4 in the growth and development of hair follicles. J Cell Mol Med. (2021) 25:1350–8. doi: 10.1111/jcmm.16241
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Philp D, Kleinman HK. Animal studies with thymosin beta, a multifunctional tissue repair and regeneration peptide. Ann N Y Acad Sci. (2010) 1194:81–6. doi: 10.1111/j.1749-6632.2010.05479.x
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Severa M, Zhang J, Giacomini E, Rizzo F, Etna MP, Cruciani M, et al. Thymosins in multiple sclerosis and its experimental models: moving from basic to clinical application. Mult Scler Relat Disord. (2019) 27:52–60. doi: 10.1016/j.msard.2018.09.035
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Kumar N, Liao TD, Romero CA, Maheshwari M, Peterson EL, Carretero OA. Thymosin beta4 deficiency exacerbates renal and cardiac injury in angiotensin-ii-induced hypertension. Hypertension. (2018) 71:1133–42. doi: 10.1161/HYPERTENSIONAHA.118.10952
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Munshaw S, Bruche S, Redpath AN, Jones A, Patel J, Dube KN, et al. Thymosin beta4 protects against aortic aneurysm via endocytic regulation of growth factor signaling. J Clin Invest. (2021) 131. doi: 10.1172/JCI127884
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Rossdeutsch A, Smart N, Dube KN, Turner M, Riley PR. Essential role for thymosin beta4 in regulating vascular smooth muscle cell development and vessel wall stability. Circ Res. (2012) 111:e89–102. doi: 10.1161/CIRCRESAHA.111.259846
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Rajendran P, Rengarajan T, Thangavel J, Nishigaki Y, Sakthisekaran D, Sethi G, et al. The vascular endothelium and human diseases. Int J Biol Sci. (2013) 9:1057–69. doi: 10.7150/ijbs.7502
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
- Neubauer K, Zieger B. Endothelial cells and coagulation. Cell Tissue Res. (2022) 387:391–8. doi: 10.1007/s00441-021-03471-2
| PubMed Abstract |
Crossref Full Text |
Google Scholar |
Ключевые слова: периферическая иммунная толерантность, дендритные клетки, Treg-клетки, сигнальный каскад mTOR, внеклеточный АТФ, аденозин, толерогенез, иммуногенез
Авторские права © 2024 Wixler, Zaytsev, Boergeling и Ludwig. Это статья открытого доступа, распространяемая на условиях лицензии Creative Commons Attribution License (CC BY) . Использование, распространение или воспроизведение на других форумах разрешается при условии указания оригинального автора(ов) и владельца(ей) авторских прав, а также ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Не допускается использование, распространение или воспроизведение, не соответствующее этим условиям.
